На стыке верхней полой вены и высокого правого предсердия находится группа клеток, называемая синусно-предсердным (СА) или синусовым узлом; СА-узел генерирует начальный электрический импульс каждого нормального сердечного сокращения. Электрический импульс этих пейсмейкерных клеток распространяется на соседние клетки, что приводит к стимуляции камер сердца в упорядоченной последовательности.
Импульсы распространяются внутри предсердия к атриовентрикулярному соединению (АВ) через предпочтительное проведение предсердных межузловых трактов и неспециализированных миоцитов. АВ-узел расположен на правой стороне межпредсердной перегородки. У него медленная скорость проведения, и, таким образом, осуществляется задержка передачи импульса. Время АВ задержки влияет на частоту сердечного ритма и модулируется вегетативный тонусом и циркулирующими в кровяном русле катехоламинами, чтобы максимизировать производительность сердца в любой момент.
Электрически предсердия изолированы от желудочков фиброзным кольцом везде, за исключением переднеперегородочной области. Там располагается пучок Гиса (продолжение АВ-узла), который входит в межжелудочковую перегородку, где раздваивается на левый и правый пучки, которые заканчиваются волокнами Пуркинье. Правая ножка пучка Гиса проводит импульсы к передним и апикальным отделам правого желудочка. Левая ножка пучка Гиса проводит по левой части межжелудочковой перегородки. Его передняя часть (левое переднее разветвление) и его задняя часть (левое заднее разветвление) стимулируют левые отделы межжелудочковой перегородки, которая активируется в первую очередь.
Таким образом, деполяризация межжелудочковой перегородки происходит слева направо, с одновременным возбуждением обоих желудочков от эндокарда к эпикардиальной поверхности.
Клетки сердечной мышцы поляризованы. Мембрана кардиомиоцитов снаружи заряжена положительно, изнутри – отрицательно. Это обусловлено тем, что внутри клеток сердца больше K+ , а снаружи – Na+ . В покое мембрана кардиомиоцитов для ионов Na+ непроницаема. У клеток рабочего миокарда потенциал покоя составляет около -90 мВ.

Рис. Концентрации и распределение ионов с внутренней и внешней стороны мембраны
Источник: Faller, The Human Body © 2004 Thieme Стр. 40 https://www.unilus.ac.zm/lms/e-books/books/Basic_Sciences/Physiological%20sciences/Faller%20et%20al.%20-%20The%20Human%20Body.pdf
Фаза 0 – деполяризация, которая характеризуется повышением натриевой проницаемости за счет активации быстрых натриевых каналов клеточных мембран. В этот период Na+ лавинообразно входит в клетку, благодаря чему происходит смена зарядов клеточной мембраны.
Фаза 1 – быстрая начальная реполяризация. Связана с активацией медленных натриевых и кальциевых каналов.
Фаза 2 – медленная реполяризация (плато), характеризующаяся дальнейшим повышением входа в клетку ионов кальция (Са2+). В период плато натриевые каналы инактивируются, и клетка находится в состоянии абсолютной невозбудимости, или рефрактерности.
Фаза 3 – быстрая конечная реполяризация обусловлена активацией калиевых каналов. В период фазы 3 закрываются кальциевые каналы, снижается вход кальция в клетку, и за счет этого ускоряется процесс реполяризации.
Фаза 4 – потенциал покоя. За счет работы калий-натриевой АТФ-азы восстанавливается градиент концентраций Na+ и K+ по обе стороны мембраны. Калий-натриевый насос представляет собой белок, встроенный в мембрану, который выкачивает из клетки ионы Na+ и закачивает обратно в клетку ионы K+ в соотношении 2/3.

Рис. Потенциал действия рабочего кардиомиоцита
Источник: Т.В.Абакумова, Д.Р.Долгова, Т.П.Генинг. Физиология кровообращения. Часть II. Физиология сердца. Учебно-методическое пособие к практическим занятиям по нормальной физиологии человека. ГОУ ВПО УГУ
Спонтанная медленная диастолическая деполяризация обусловлена проницаемостью мембран пейсмеккерных клеток для натрия и кальция, медленное поступление которых внутрь клетки способствует постепенному изменению мембранного потенциала и достижению критического уровня деполяризации мембраны, что приводит к возникновению потенциала действия.
Различия по форме потенциала действия клеток сердца представлены на рисунке далее:

Рис. Форма потенциала действия клеток проводящей системы сердца и рабочих кардиомиоцитов в зависимости от их локализации
Источник: Witczy ´nska, A.; Alaburda, A.; Grze´sk, G.; Nowaczyk, J.; Nowaczyk, A. Unveiling the Multifaceted Problems Associated with Dysrhythmia. Int. J. Mol. Sci. 2024, 25, 263. https://doi.org/ 10.3390/ijms25010263
Механизмы нарушений ритма сердца
Раздел I. Физиология сердечной мышцы
Для сердечной мышцы характерны следующие свойства:
1.Автоматизм
2.Возбудимость
3.Проводимость
1. Автоматизм — способность спонтанно генерировать потенциал действия. Данным свойством обладают все клетки проводящей системы сердца (атипичные кардиомиоциты), а для клеток сократительного миокарда (рабочих кардиомиоцитов) в норме оно не характерно.

Рис. Потенциал действия атипичного кардиомиоцита
Адаптировано из источника: Глебов, А. Н. Патофизиология нарушений ритма сердца : учеб.-метод. пособие
0 – быстрая деполяризация
3 – быстрая реполяризация
4 – спонтанная медленная диастолическая деполяризация
5 – критический уровень деполяризации - уровень мембранного потенциала, при котором возникает ПД.
В основе свойства автоматизма лежит явление спонтанной медленной диастолической деполяризации, которое представляет собой постепенное уменьшение мембранного потенциала за счет медленных входящих токов кальция и натрия. В результате спонтанной медленной диастолической деполяризации мембранный потенциал постепенно достигает критического уровня деполяризации, что приводит к запуску потенциала действия, то есть, по сути, к самопроизвольному возбуждению атипичного кардиомиоцита.
Как уже было сказано выше, свойство автоматизма характерно для всех клеток проводящей системы сердца. При этом, согласно принципу градиента автоматии, частота спонтанной генерации импульса постепенно уменьшается по направлению от синоатриального узла (СА-узла) к волокнам Пуркинье.
Основным водителем ритма (пейсмейкером 1-го порядка) является СА-узел, генерирующий импульс с частотой 60-90 уд/мин. В норме автоматизм нижележащих отделов проводящей системы подавляется импульсом, исходящим из СА-узла. При нарушении образования импульса СА-узлом водителем ритма становится АВ-узел. При нарушении функции АВ-узла – пучок Гиса, и так далее.
2. Возбудимость — свойство, характерное для клеток возбудимых тканей, и заключающееся в способности воспринимать раздражение и реагировать на него возбуждением. Иными словами, это способность выполнять определенную функцию в ответ на действие раздражителя. Так, кардиомиоциты в ответ на раздражение способны генерировать потенциал действия, проводить его, а также, если говорить о рабочих кардиомиоцитах, сокращаться.
3. Проводимость — способность кардиомиоцитов проводить импульсы возбуждения.
Раздел II. Патофизиология нарушений ритма сердца
В основе патогенеза аритмий лежит нарушение образования и/или проведения импульса.

Схема. Патогенез нарушений ритма сердца
Адаптировано из источника: Глебов, А. Н. Патофизиология нарушений ритма сердца : учеб.-метод. пособие
1. Нарушения образования импульса
Нарушение образования импульса может быть обусловлено нарушением автоматизма или повышением возбудимости кардиомиоцитов.
1.1. Изменение нормального автоматизма
Изменение нормального автоматизма ведет к возникновению синусовых аритмий и может возникать при реализации следующих механизмов:
Таблица. Механизмы изменения нормального автоматизма
Адаптировано из источника: Глебов, А. Н. Патофизиология нарушений ритма сердца : учеб.-метод. пособие
Таким образом, чем быстрее мембранный потенциал клетки достигает критического уровня деполяризации, тем чаще сердечный ритм, и наоборот.
1.2. Аномальный автоматизм
Аномальный автоматизм может лежать в основе экстрасистолии и тахикардий, как наджелудочковых, так и желудочковых.
Аномальный автоматизм представляет собой проявление пейсмейкерной активности клетками, в норме не являющимися водителями ритма, то есть любыми клетками за исключением расположенных в синоатриальном узле.
Условиями для реализации механизма аномального автоматизма могут являться следующие:
- повышение концентрации катехоламинов
- ишемия миокарда
- электролитные нарушения и т.д
Например, при нарушении кровоснабжения и, соответственно, недостаточном поступлении кислорода к миокарду, даже рабочие кардиомиоциты могут приобретать свойство автоматизма, в норме для них нехарактерное.
1.3. Триггерная активность
Триггерная активность (триггерный автоматизм) заключается в повышении возбудимости кардиомиоцитов и основана на преждевременной деполяризации мембраны - появлении ранних или поздних постдеполяризаций, которые могут обуславливать развитие как экстрасистолии, так и тахикардий, в том числе жизнеугрожающих, например, желудочковой тахикардии типа пируэт.
Ранняя постдеполяризация представляет собой преждевременную деполяризацию мембраны, возникающую в тот момент, когда фаза реполяризации еще не окончена. Этому способствуют удлинение фазы реполяризации, брадикардия. Возникновение ранних постдеполяризаций становится более вероятным, в случае ишемии, гипокалиемии, ацидоза.
Поздняя постдеполяризаация возникает сразу после окончания фазы реполяризации.
Несмотря на то, что колебания мембранного потенциала в фазе потенциала покоя постоянно присутствуют в клетке, в норме они не достигают критического уровня деполяризации. Однако, при патологических состояниях, например, ишемии, передозировке сердечных гликозидов, амплитуда колебаний увеличивается, в результате чего становится возможным достижение порогового мембранного потенциала и развитие потенциала действия или даже серии ПД, то есть появление экстрасистолии или тахикардии.

Рис. Потенциал действия: триггерная активность: а — ранняя постдеполяризация; б — поздняя постдеполяризация
Источник: Глебов, А. Н. Патофизиология нарушений ритма сердца : учеб.-метод. пособие
2. Нарушения проведения импульса
2.1. Замедление или блокада проведения импульса
Препятствия к проведению импульса могут быть функциональными и структурными. Например, в том случае, если импульс достигнет клеток, находящихся в периоде рефрактерности, он не будет проведен дальше, однако распространение следующего импульса может быть не нарушено, если возбудимость клеток успела восстановиться к моменту его поступления. В этом случае речь идет о функциональной блокаде.
Если же неспособность какого-то участка сердца к возбуждению обусловлена наличием неустранимого препятствия, например в виде рубцовой ткани, то блокада проведения импульса будет постоянной.
2.2. Механизм повторного входа импульса (re-entry)
В норме импульс, возникший в синоатриальном узле распространяется по сердцу в анетроградном направлении.
Механизм re-entry заключается в циркуляции волны возбуждения по петле из взаимосвязанных между собой путей проведения (α и β), для одного из которых (β) характерно наличие односторонней блокады проведения, то есть утрата способности проводить импульсы в антероградном направлении, при сохранении способности проводить импульсы в ретроградном направлении.
В этом случае импульс, беспрепятственно прошедший по первому пути (α) в антероградном направлении, проходит по второму пути (β) в ретроградном направлении и возвращается к области своего возникновения. Если к этому моменту первый путь (α) вышел из состояния рефрактерности, то возникает повторный вход импульса на первый путь, затем снова на второй, и развивается циркуляция возбуждения между обоими путями, что приводит к запуску тахикардии.
В зависимости от размера петли циркуляции возбуждения различают, соответственно, макро re-entry и микро re-entry.

Рис. Механизм повторного входа импульса (re-entry)
2.3. Сверхнормальное проведение
В норме импульс проводится от предсердий к желудочкам с некоторой задержкой, что связано с особенностями функционирования АВ-узла. Однако, при наличии дополнительных путей проведения (например, пучки Кента, Джеймса и т.д) импульс распространяется от предсердий к желудочкам в обход АВ-соединения гораздо быстрее.
Несмотря на то, что в последние годы все более широкое распространение приобретают немедикаментозные методы лечения нарушений ритма сердца, в связи с невозможностью достижения 100%-го устранения аритмии, дороговизной, недостаточной доступностью данных методик, а также длительным периодом ожидания вмешательства, антиаритмическая терапия становится краеугольным камнем не столько с экономической точки зрения, сколько в связи с необходимостью улучшения качества жизни пациентов с симптомной аритмией, для которых оперативное лечение по какой-то причине недоступно.
Поскольку профилактика рецидивов аритмии не всегда улучшает прогноз, но положительно влияет на качество жизни пациентов, назначение антиаритмических препаратов при нежизнеугрожающих нарушениях ритма показано преимущественно симптомным пациентам.
Антиаритмические препараты. Классификация
Наиболее полной с точки зрения указания влияния конкретных антиаритмических препаратов на ионные каналы, рецепторы, насосы, а также с точки зрения описания клинических эффектов и ЭКГ-изменений на фоне приема указанных препаратов, является классификация Сицилианский гамбит.

Табл. Антиаритмические препараты: влияние на ионные каналы, рецепторы, Na+-K+-АТФ-азу; клиническая эффекты препаратов; изменения ЭКГ на фоне приема препаратов
Источник: https://figures.semanticscholar.org/5c17d4a5f00d449fe77b2c5ac71764d34f63026a/3-Figure2-1.png
дата обращения 22.11.2024 Figure 2. Framework for classification of drugs proposed in the Sicilian Gambit (Japanese version).3 Relative blocking potency: low moderate high; A, activated state channel blocker; I, inactivated state channel blocker; , agonist; ATP, adenosine triphosphate; LV, left ventricular; ECG, electrocardiogram. Modified from Members of the Sicilian Gambit, Antiarrhythmic therapy: a pathophysiologic approach. New York: Futura Publishing Company, Inc; 1994.
Поэтому наиболее широкое применение в клинической практике нашла именно классификация по Vaughan-Williams (Вогана-Вильямса).

Табл. Классификация антиаритмических препаратов
Источник: V. Williams, 1970; D. Harrison, 1981; В.И. Метелица, 1996; с дополнениями
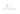
Табл. Классы антиаритмических препаратов и их влияние на фазы потенциала действия
Источник: М.В. Леонова, И.С. Явелов, А.А.Упницкий, Е.О.Борисова, В.Н.Ларина, Н.А.Егорова. Клиническая фармакология в кардиологии. Практическое руководство для врачей под ред. М.В. Леоновой, Москва, 2023, адаптировано в форму таблицы и дополнено схемами.
Антиаритмические препараты 1С класса относятся к группе блокаторов натриевых каналов и включают такие препараты, как флекаинид, пропафенон, этмозин, этацизин.
Влияние на потенциал действия
Для группы 1 С характерно максимальное среди всех представителей I класса угнетение фазы 0 при отсутствии значимого влияния на продолжительность потенциала действия.
Механизм действия
Антиаритмические средства класса IC, блокируя потенциалзависимые натриевые каналы мембран кардиомиоцитов, вызывают уменьшение скорости поступления натрия в клетку в фазу 0 ПД, благодаря чему происходит увеличение продолжительности фазы 0, замедление проведения сердечного импульса и подавление спонтанных преждевременных желудочковых сокращений. Данные препараты уменьшают проводимость предсердий, атриовентрикулярного узла, желудочков и волокон Пуркинье. В последних данный эффект наиболее выражен. На ЭКГ действие антиаритмиков 1С класса проявляется удлинением интервала PR и расширением комплекса QRS.
В 2024 году в РФ зарегистрирован и поступил в продажу широко используемый за рубежом и одобренный FDA в 1985-м году препарат Флеикардил® (МНН - флекаинид)
Показания к применению
Препарат Флеикардил® показан для профилактики и лечения нарушений сердечного ритма у взрослых пациентов старше 18 лет без нарушения функции левого желудочка:
- документально подтвержденная симптомная пароксизмальная наджелудочковая тахикардия, в т.ч. атриовентрикулярная (AV) узловая реципрокная тахикардия или наджелудочковая тахикардия, связанная с наличием дополнительных проводящих путей (например, при синдроме Вольфа-Паркинсона-Уайта)
- пароксизмальная фибрилляция или трепетание предсердий, сопровождающиеся инвалидизирующими симптомами
- документально подтвержденные жизнеугрожающие желудочковые аритмии, такие как устойчивая желудочковая тахикардия.
Препарат Флеикардил® можно применять для поддержания нормального сердечного ритма после его восстановления другими антиаритмическими средствами.
Противопоказания
- гиперчувствительность к флекаиниду или к любому из вспомогательных веществ, перечисленных в разделе 6.1.
- бессимптомные или нежизнеугрожающие желудочковые аритмии
- кардиогенный шок, сердечная недостаточность
- острый инфаркт миокарда
- инфаркт миокарда в анамнезе (за исключением пациентов с жизнеугрожающими желудочковыми аритмиями)
- тяжёлая артериальная гипотензия
- выраженная брадикардия (менее 50 ударов в минуту), синдром слабости синусового узла или синдром брадикардии — тахикардии (если не имплантирован электрокардиостимулятор)
- AV блокада II и III степени или синоатриальная блокада (при отсутствии имплантированного электрокардиостимулятора), блокады ножек пучка Гиса или дистальные нарушения внутрижелудочковой проводимости
- длительно сохраняющаяся фибрилляция предсердий пациентов, у которых не было попыток восстановить синусовый ритм
- синдром Бругада
- гемодинамически значимый клапанный порок сердца
- одновременное применение антиаритмических препаратов класса I
- значительные электролитные нарушения
О препарате
-
Включен в действующие рекомендаци ESC по лечению пациентов с фибрилляцией предсердий, наджелудочковыми тахикардиями, с желудочковыми нарушениями ритма1
1 ESC Guidelines. European Heart Journal, том 42, выпуск 5, 1 февраля 2021 г., страницы 373–498, https://doi.org/10.1093/eurheartj/ehaa612;
Европейский кардиологический журнал, том 41, выпуск 5, 1 февраля 2020 г., страницы 655–720, https://doi.org/10.1093/eurheartj/ehz467; Европейский кардиологический журнал, том 43, выпуск 40, 21 октября 2022 г., страницы 3997–4126, https://doi.org/10.1093/eurheartj/ehac262 -
Обладает обширной доказательной базой, одобрен FDA с 1985 года2
2 Basza M, Maciejewski C, Bojanowicz W, Balsam P, Grabowski M, Mitkowski P, Kempa M, Kowalski O, Kalarus Z, Jaguszewski M, Lubiński A, Daniłowicz-Szymanowicz L, Szumowski Ł, Sterliński M, Kołtowski Ł. Flecainide in clinical practice. Cardiol J. 2023;30(3):473-482. doi: 10.5603/CJ.a2023.0018. Epub 2023 Mar 13. PMID: 36908162; PMCID: PMC10287070 -
Позволяет осуществлять раннюю кардиоверсию при меньших затратах для системы здравоохранения и относительно низком риске для пациента2
-
Имеет лучшее соотношение рисков рецидива мерцательной аритмии среди представителей своего класса3
3 Валембуа Л., Одюро Э., Такеда А. и др. Антиаритмические средства для поддержания синусового ритма после кардиоверсии при мерцательной аритмии. Кокрейновская система баз данных, ред. 2019 г.; 9 (9):CD005049.doi: 10.1002/14651858.CD005049.pub5 -
наличие 2-х дозировок дает возможность подбора оптимальной терапии

При пероральном приеме флекаинид хорошо всасывается, его биодоступность приближается к 90-95%. Связывание с белками плазмы крови 32-58%. Флекаинид метаболизируется при участии изофермента CYP2D6. Период полувыведения (T1/2) составляет 12-27 ч. Флекаинид и его метаболиты выводятся в основном с мочой. Около 5% введенной дозы выводится с калом.
Фармакологическое действие
Антиаритмическое средство класса IC по классификации Вогана-Вильямса. Связывается с натриевыми каналами мембран кардиомиоцитов, вызывая мощное замедление проведения сердечного импульса и подавления спонтанных преждевременных желудочковых сокращений.
Флекаинид прочно связывается с быстрыми натриевыми каналами и, таким образом, замедляет скорость деполяризации и снижает проводимость в предсердиях, атриовентрикулярном узле, желудочках и волокнах Пуркинье. Наиболее выраженное воздействие наблюдается в волокнах Пуркинье. Флекаинид также повышает рефрактерность антероградных и, особенно, ретроградных дополнительных проводящих путей. Обладает отрицательным инотропным действием и местноанестезирующим действием.
Флекаинид обычно не влияет на ЧСС. В клинических исследованиях систолическое и диастолическое АД незначительно повышалось во время терапии. Нескольким пациентам потребовалось изменение в приеме антигипертензивных препаратов.
Снижение фракции выброса левого желудочка вследствие отрицательного инотропного действия наблюдалось после однократного приема 200–250 мг флекаинида. При многократном применении в обычных терапевтических дозах у пациентов наблюдалось снижение фракции выброса. В ходе длительных клинических исследований у некоторых пациентов развилась застойная сердечная недостаточность во время приема флекаинида.
В отличие от широко применяемого в РФ пропафенона, флекаинид, во-первых, не обладает бета-адреноблокаирующими свойствами, в связи с чем не противопоказан при обструктивной болезни легких, а во вторых, за счет преобладания почечного пути элиминации, в отличие от пропафенона не противопоказан при холестазе.

Табл. Отличия флекаинида от пропафенона
Адаптировано из:
1.EP Europace , том 20, выпуск 5, май 2018 г., страницы 731–732an, https://doi.org/10.1093/europace/eux373
2.Королева О.С., Затейщиков Д.А. Катехоламинергическая полиморфная желудочковая тахикардия // Трудный пациент. 2013. №5. URL: https://cyberleninka.ru/article/n/kateholaminergicheskaya-polimorfnaya-zheludochkovaya-tahikardiya (дата обращения: 18.07.2024).
3.А.В.Тарасов. Вопросы безопасности антиаритмической терапии. Consilium Medicum. 2014; 10: 44-49
4.Alboni P, Botto GL, Baldi N, et al. Outpatient treatment of recent-onset atrial fibrillation with the ”pill-in-the-pocket” approach. N Engl J Med. 2004;351(23):2384–2391. doi: 10.1056/NEJMoa041233 5.https://academic.oup.com/europace/article/20/5/731/4846844?login=false 6.https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10287070/#b13-cardj-30-3-473
7.2020 ESC Guidelines for the diagnosis and management of atrial fibrillation https://doi.org/10.1093/eurheartj/ehaa612
8. 1310-1-3-1-ohlp-allapinin-ot-10-08-2023 (1501672471) [0001] штамп МЗ.pdf
9.ОБЩАЯ ХАРАКТЕРИСТИКА ЛЕКАРСТВЕННОГО ПРЕПАРАТА_V4 (1578037511) [0005] штамп МЗ.pdf
Изменение на ЭКГ, являющееся основанием для снижения дозы или отмены флекаинида - увеличение длительности QRS >25% по сравнению с исходным значением.
Согласно действующим клиническим рекомендациям «Фибрилляция и трепетание предсердий» РКО (от 2020 г.) данный критерий отмены применим для всех представителей 1С класса.

Рис. Изменения ЭКГ на фоне приема флекаинида
Источник: Баша М, Мациевски С, Боянович В, Бальзам П, Грабовски М, Митковски П, Кемпа М, Ковальски О, Каларус З, Ягушевский М, Лубински А, Данилович-Шиманович Л, Шумовский Л, Стерлински М, Колтовски Л. Флекаинид в клинической практике. Кардиол Дж. 2023;30(3):473-482. doi: 10.5603/CJ.a2023.0018. Epub, 13 марта 2023 г. PMID: 36908162; PMCID: PMC10287070.
- пароксизмальная фибрилляция или трепетание предсердий, сопровождающаяся инвалидизирующими симптомами;
- документально подтвержденная пароксизмальная наджелудочковая тахикардия с клиническими симптомами, в т.ч. AV узловая реципрокная тахикардия или наджелудочковая тахикардия, связанная с наличием дополнительных проводящих путей (например, при синдроме Вольфа-Паркинсона-Уайта);
- документально подтвержденные жизнеугрожающие желудочковые аритмии, такие как устойчивая желудочковая тахикардия.
Препарат может применяться для контроля ритма после его восстановления другими антиаритмическими средствами.
Дозирование Флекаикардила® при наджелудочковых аритмиях
- Рекомендуемая начальная доза для лиц старше 18 лет - 50 мг 2 раза в сутки.
- У большинства пациентов контроль состояния будет достигаться при применении данной дозы.
- При необходимости, дозу можно повысить до максимальной — 300 мг в сутки.
- В случае применения препарата Флеикардил® в терапии желудочковых нарушений ритма сердца максимальная суточная доза составляет 400 мг/сут.
Форма выпуска: таблетки 50мг № 60 и 100мг № 30.
Производитель препарата Флеикардил®: АО «ОХФК» (АО "Обнинская химико-фармацевтическая компания")
Место Флеикардила® в обновленных рекомендациях по лечению фибрилляции и трепетания предсердий ESC 2024.
В действующих клинических рекомендациях по лечению ФП и ТП указано, что при небольшом сроке ФП (до 3 месяцев) следует отдавать предпочтение катетерным методикам изоляции легочных вен, а при длительном анамнезе ФП и увеличении полости ЛП — методикам изоляции ЛВ и задней стенки ЛП. Причем при длительно существующей ФП наиболее эффективен гибридный способ лечения (хирургическая + катетерная абляция). Рассмотрим методы немедикаментозного лечения аритмий более подробно.
Катетерная абляция (КА)
Наиболее широко используемым методом немедикаментозного лечения ФП является внутрисердечная катетерная аблация. Катетерная абляция проводится в условиях рентгеноперационной с использованием управляемых катетеров, перемещаемых в камеры сердца через сосудистые доступы (бедренные и подключичные вены). Целью катетерной аблации является радикальное устранение/изоляция источника аритмии. В настоящее время широко применяются в клинической практике две разновидности катетерной аблации - радиочастотная катетерная аблация и криобаллонная аблация.
- Радиочастотная абляция заключается в нанесении точечных трансмуральных повреждений при помощи электродов. В результате формируется непрерывная цепь, изолирующая устья легочных вен.
Ход процедуры: При помощи проводников, введенных через бедренные и левую подключичную вены, осуществляется проведение электродов в полость правого предсердия. Далее выполняется пункция межпредсердной перегородки и введение электрода в полость левого предсердия. Далее выполняется картирование и трехмерная реконструкция левого предсердия, после чего наносится серия точечных воздействий радиочастотной энергией, подаваемой через электрод, на область вокруг устьев легочных вен, а также, частично, на стенки левого предсердия.
- Криобаллонная абляция позволяет добиться изоляции легочных вен путем однократных холодовых воздействий на их устья с помощью баллона, имеющего специальную систему охлаждения.
Ход процедуры: Баллон для криоабляции при помощи проводника (интродьюсера) проводится в полость правого предсердия. Далее выполняется пункция межпредсердной перегородки и введение электрода в полость левого предсердия. Затем баллон вводится в устье легочной вены, раздувается, благодаря чему обеспечивается его плотное прилегание к стенке сосуда, и охлаждается по системе портов. За счет холодового воздействия формируется повреждение в виде кольца, которое изолирует устье вены и препятствует распространению формирующихся в данной области патологических импульсов к левому предсердию, что способствует профилактике рецидивов фибрилляции предсердий. Процедура повторяется для каждой из четырех легочных вен.
Показания к применению катетерной абляции:
- Катетерная абляция (изоляция) легочных вен рекомендуется пациентам, которые на фоне антиаритмической терапии имеют симптоматические рецидивы ФП и предпочитают в дальнейшем контроль ритма.
- Абляция кава-трикуспидального перешейка рекомендуется пациентам с типичным трепетанием предсердий при неэффективной антиаритмической лекарственной терапии или в качестве первой линии лечения с учетом предпочтений пациента.
- Катетерная аблация (деструкция) АВ узла применяется в тех случаях, когда ФП сопровождается стойким повышение частоты сердечных сокращений при невозможности медикаментозного контроля или радикального устранения ФП. Аблация АВ узла проводится только после имплантации искусственного водителя ритма (кардиостимулятора).
Эпикардиальная изоляция легочных вен и задней стенки левого предсердия (ЛП)
В том случае, когда катетерная абляция оказалась неэффективной, пациенту с симптомной фибрилляцией предсердий может быть рекомендовано мини-инвазивное (торакоскопическое) вмешательство с эпикардиальной изоляцией легочных вен и задней стенки ЛП.
Изоляцию ЛВ во время сопутствующей операции целесообразно применять только у пациентов с пароксизмальной ФП. При персистирующих формах ФП целесообразно осуществить хирургическое вмешательство (операцию «лабиринт»).
Хирургическое лечение
Хирургическое лечение с помощью мини-инвазивного подхода, выполняемое в центре, имеющем большой опыт выполнения данного вида вмешательства, может быть рекомендовано пациентам с симптомными персистирующими формами ФП или после неэффективной катетерной абляции.
Пациентам с ФП, переносящим операцию на сердце (АКШ, клапанные пороки сердца) для облегчения симптомов, связанных с ФП, может рекомендована операция «лабиринт». При этом необходимо сопоставление дополнительного риска процедуры и преимущества контроля ритма.
Мнения пациентов и реальность
Несмотря на распространенное среди пациентов мнение о том, что оперативное вмешательство избавляет от аритмии и необходимости принимать лекарства, эффективность хирургического и интервенционного лечения не достигает 100%. Немалая доля пациентов сталкивается с рецидивами аритмии. Например, в исследовании NO-PERSAF предсердные тахиаритмии были зарегистрированы у 16 из 52 пациентов в группе криоаблации и у 19 из 49 пациентов в группе радиочастотной аблации.
В клинических рекомендациях, учитывая вероятность рецидива аритмии, прописано, что назначение антикоагулянтной терапии не зависит от эффективности проведенной процедуры, а основано в первую очередь на стратификации риска инсульта. Также после оперативных вмешательств, как минимум в течение 3-х месяцев, а зачастую и на неопределенно длительный срок пациентам рекомендуют прием антиаритмической терапии.

